浅谈炙手可热的MRD技术

前言
目前,包括手术在内的根治性治疗是早中期肿瘤患者的主要治疗手段,但仍有相当比例患者在根治性治疗后出现复发转移。传统影像学评估的“根治”和复发看似相悖,其实这恰恰代表了疾病治愈和进展之间还存在一种中间状态——MRD。当下,MRD已成为当仁不让的热门标志物,但转而也带来技术的群雄争霸和产品的鱼龙混杂。如何快速、精准识别其性能好坏?即日起,世和基因特别推出《MRD技术系列解析》科普专题,将用客观的态度拆解MRD关键技术指标,以飨读者。本篇是为MRD背景知识前导文。
浅谈炙手可热的MRD技术
MRD技术系列解析(一):单点突变灵敏度
MRD技术系列解析(二):监测突变数量
MRD技术系列解析(三):背景噪音干扰
如何快速识别MRD产品性能
MRD的含义和临床意义
MRD,常译为微小残留病灶(Minimal Residual Disease),主要指肿瘤患者经过根治性治疗后,经传统影像学或实验室方法不能发现,但通过液体活检能发现的癌来源细胞或异常分子。
实体瘤中的MRD通常指分子残留病灶,血浆ctDNA是评估MRD最成熟的媒介,其检测已被写入包括《非小细胞肺癌分子残留病灶专家共识》、《NCCN结肠癌临床实践指南》在内的多个指南/共识。目前,MRD技术在肿瘤中的应用价值主要有以下3点:
评估预后,选择治疗
基于ctDNA的MRD检测可进行复发风险分层,评估患者预后。据此可辅助临床甄别潜在治疗豁免和获益人群,匹配精准治疗方案。
监控复发,及时干预
MRD能早于影像学及传统临床手段发现疾病复发,为患者创造及时干预的宝贵机会。
评估疗效,调整方案
基于ctDNA的MRD监测可以早期预测评估治疗疗效,为停药观察、方案调整、继续治疗提供参考依据。
浅析MRD两大技术流派
不同的MRD研究虽然都得出整体正向的研究结论,但研究之间关于MRD的检测方法、判读标准尚存较大差异。当前,基于NGS的MRD检测技术路径主要划分为两大流派(图1):
1、Tumor-naïve assays:即肿瘤未知分析。这种策略的关键是不依赖于原发肿瘤组织,基于一组预先设计与本癌种相关的固定化Panel进行ctDNA监测。固定化Panel的使用能极大简化检测流程并缩短评估周期,在规避肿瘤组织时空异质性带来的检测测偏差方面更为可靠,但灵敏度相对而言稍显不足。
2、Tumor-informed assays:即肿瘤知情分析。该策略一般需先对原发肿瘤组织进行全面的基因组测序,据此定制个体化Panel,对组织中一定数量的突变位点(通常包含16-50个肿瘤特异突变)进行后续的ctDNA动态监测。个体化Panel因监控靶点较少,可实现较高的测序深度进而提升灵敏度。但它对于肿瘤复发过程中出现的新发突变覆盖不足,且对于局晚期根治性放化疗后等无法获得组织样本的患者适用性较差。
是否检测并参考原发肿瘤组织是两种策略的重要区别。
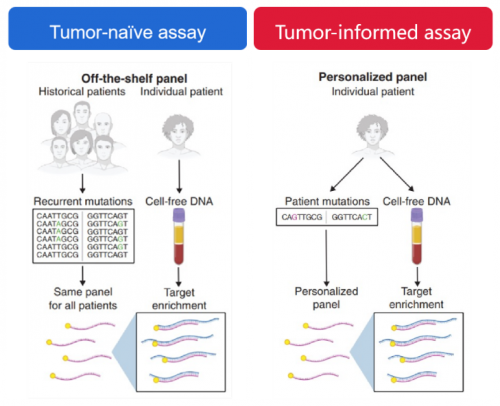
图1. 两种MRD检测技术策略
何为评估MRD性能的关键因素?
个体化Panel和固定化Panel孰优孰劣之争一直没有停息,但即使同一种技术策略下的检测产品也性能各异。当“李逵”“李鬼”傻傻分不清楚时,下面几个关键指标可助您快速练就识别MRD产品的火眼金睛。(此处仅作抛砖引玉,关于几个指标的详细解读会安排在后续专题)
单点突变灵敏度:MRD检测最大瓶颈
单点突变灵敏度,即血浆ctDNA中单一突变的最低检测下限。TRACERx研究已经表明肿瘤体积和ctDNA浓度成正向线性关系[1],每cm3肿瘤病灶对应血浆中的ctDNA丰度仅约在0.008%(图2)。经过根治性治疗后患者残存的肿瘤细胞则更少,血浆中ctDNA释放也更低,这就要求MRD检测灵敏度需达到万分位的数量级。如果再考虑临床实际采血量不足及提取和测序流程中的损耗,最终能够捕获到的分子异常更是微乎其微。因此检测灵敏度,尤其单点突变灵敏度是为MRD检测的最大瓶颈。当因技术灵敏度不足造成MRD判断为假阴性时,临床则会错失患者干预的最佳时间窗。
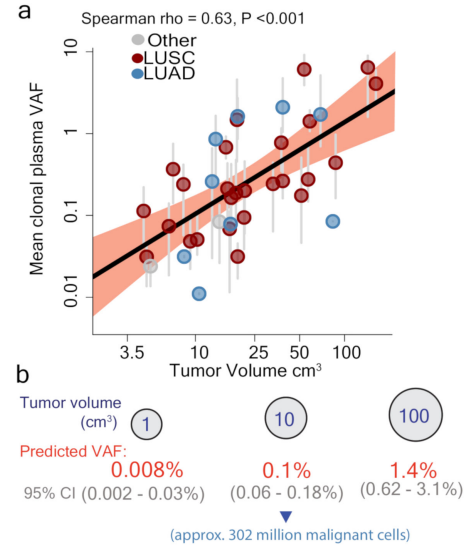
图2. NSCLC肿瘤体积与血浆VAF间的线性关系
监测突变数量:并非越多越好
监测突变数量可能会影响MRD技术的灵敏度,一般认为监测的突变数量越多,灵敏度也会越高。不过,基于增加监测突变数量提升灵敏度是有其天花板的,超出一定范围的无限增加对灵敏度的提升效果微乎其微,此外还将牺牲其特异性(图3),并导致在某些组织中检测失败率的增加[1]。故监测突变数量并不能一刀切似地认为越多越好,监测突变数量少≠检测性能差。要想兼顾灵敏度与特异性,无论个体化Panel还是固定化Panel,以能对各癌种突变有适当数量覆盖为佳。
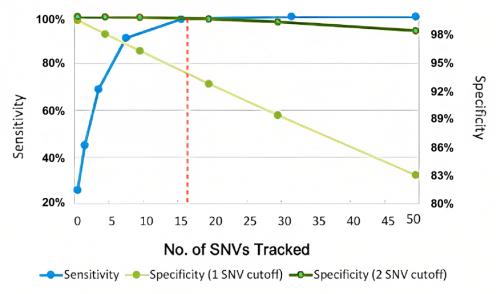
图3. 监测突变数量与灵敏度和特异性的关系
ctDNA≠MRD:MRD背景噪音影响特异性
诚然,MRD状态需基于ctDNA突变来评估,但并非检测到的任意突变都会被当成MRD阳性。在技术实现层面,文库富集和PCR过程中会产生诸如单链错误或引入随机错误,此时如果不进行背景纯化而单纯增加测序深度,只会放大其对MRD判读的干扰;与此同时,克隆性造血突变也会带来生物学背景噪音,将以上变异误判为肿瘤特有势必会强烈干扰检测信号的判断,进而影响MRD检测特异性,最终造成临床实践的巨大偏差。
如何快速判断MRD产品性能:临床真实世界验证为最强证明!
在各大肿瘤基因检测公司纷纷进入MRD赛道的前提下,市面上MRD检测产品五花八门,性能良莠不齐。与国外不同,国内目前尚无基于NGS评估的MRD产品获批上市,技术性能的好坏只有临床真实世界研究能够证明,因此,临床医生可优先考虑经过临床性能验证且有相应重磅科研成果发表的检测产品。
结语
MRD正当时,如何打通从概念到应用、从预后到干预的最后一公里,检测技术的不断优化及大规模干预式研究不可或缺。《MRD技术系列解析》科普专题持续更新中,请期待接下来我们对MRD具体检测性能的拨云见日。
参考文献
[1] Abbosh C, et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 2017 Apr 26;545(7655):446-451.
-
NASA火星毅力漫游车拍摄的惊人360度高清全景着陆点
2022-06-10 -
西班牙寒冷的毯子 - 西班牙大雪卫星图像
2022-05-30 -
古代金属的天文仪器狩猎 - 看着Quasars探索血液中铁的起源
2022-05-26 -
美欧Sentinel-6海平面卫星准备发射
2022-05-16 -
美国宇航局从空间和空中追踪加利福尼亚的野火
2022-05-11 -
先进的新型航天器将以极高的精度监视海平面上升和大气温度
2022-05-06 -
由Noaa / Nasa卫星捕获的大角型火灾63英里的烟雾迹
2022-04-20 -
“节省哈勃的相机”的令人难以置信的故事
2022-04-18 -
7年来,proba-v监测了所有地球植被的日常增长 - 现在它有一个新的使命
2022-04-15 -
太阳能轨道科学仪器将首次测量结果发送给地面控制
2022-03-27 -
卫星图像显示澳大利亚的凶猛火灾加剧了
2022-03-26 -
Landsat 9科学仪器附着在宇宙飞船上 - 发射更近一步
2022-03-22 -
迎接NASA的“称重”看不见的行星的新工具[视频]
2022-03-20 -
NASA SnowEx空降战役赶上了积雪的漂流
2022-03-20










