阿尔茨海默病原因追踪常见酶的遗传突变
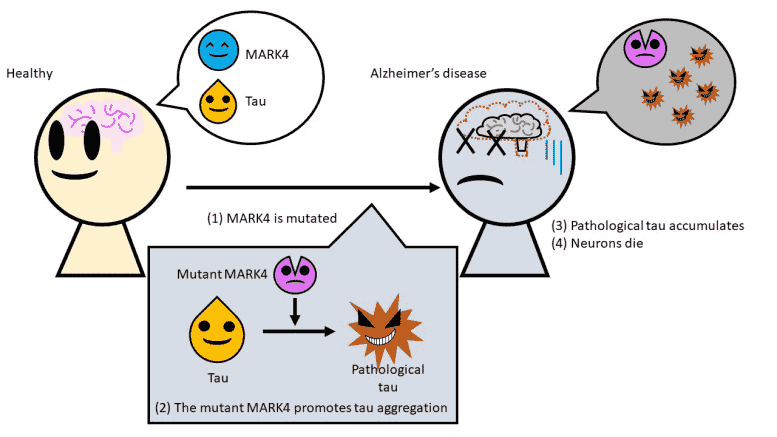
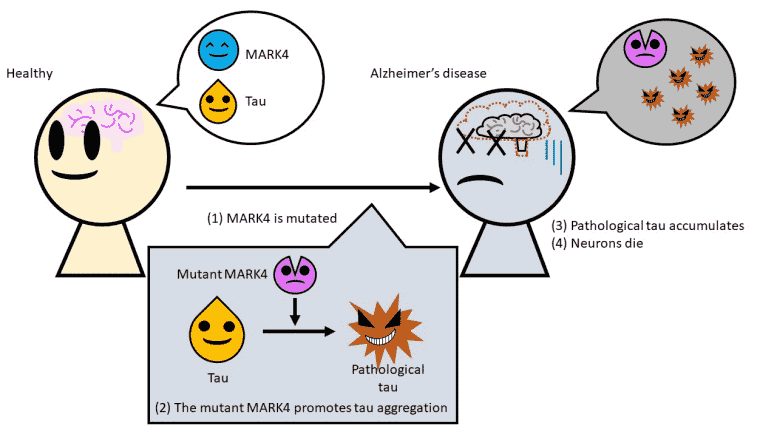
突变体Mark4创造了一种形式的Tau,其在脑细胞中容易累积,导致神经元死亡。
Mark4的突变使蛋白质粘连,更可能丛生于脑中。
来自东京都大学的研究人员发现了一种新的机制,在大脑中产生了Tau蛋白的丛,杀死脑细胞并导致阿尔茨海默病。对称为MARK4的酶的特定突变改变了TAU的性质,通常是细胞骨骼结构的重要组成部分,使其更可能骨料,更不溶于不溶性。使用这样的机制掌握可能导致突破性处理。
阿尔茨海默病是一种改变生活的衰弱条件,影响全球数以千万万人。根据世界卫生组织的说法,它是老年痴呆症最常见的原因,如果未经检查,全球数量预计每20年一次。
据说阿尔茨海默氏症是由脑细胞中称为“Tau”的缠结丛的积聚引起的。这些粘性骨料导致神经元死亡,导致记忆力和电机功能损害。目前尚不清楚如何以及为什么Tau在阿尔茨海默氏症患者的脑细胞中产生。了解这种不受欢迎的丛生背后的原因和机制将向新的治疗方法和预防疾病的方式开辟道路。
由东京大都会大学的副教授Kanae Ando领导的团队一直在探索Mark4(Microtubule亲和调节激酶4)酶在阿尔茨海默病中发挥的作用。当一切正常工作时,Tau蛋白是细胞结构或细胞骨架的重要组成部分。为了保持细胞骨架的臂或微管不断建立和拆卸,Mark4实际上有助于从这种结构的武器脱离。
当突变发生在基因中,在提供MARK4的蓝图的基因中发生时开始。以前的工作已经有了这么多的Alzheimer风险,但尚不知道为什么这是如此。该团队人工将突变引入转基因果蝇果蝇中,这些果蝇也产生人性Tau,并研究了蛋白质如何改变体内。他们发现,这种Mark4的突变形式是对Tau蛋白的变化,产生了一种病理形式的TAU。这不仅是这种“坏”的Tau有多余的某些化学群,导致它误用,它们发现它更容易聚集并且不再溶于洗涤剂。这使Tau更容易形成导致神经元堕落的缠结的团块。
MARK4也已被发现引起各种其他疾病,这些疾病涉及其他蛋白质的聚集和累积。这就是为什么球队对Tau蛋白质累积的见解可能导致新的治疗和预防措施,甚至更广泛的神经变性条件。
参考:“微管亲和力调节激酶4与阿尔茨海默病相关的突变促进了Tosiya Oba,Taro Saito,Akiko Asada,Sakako Shimizu,Koichi M Iijima和Kanae Ando,2020年Chinoctions.do :
10.1074 / JBC.RA120.014420
这项工作得到了对创新区域(脑蛋白衰老和痴呆症控制)的科学研究的补助金(JSPS Kakenhi Grant Number 17H05703),这是Hoan-Sha Foundation,Takeda科学基金会,研究奖日本老龄化与卫生基金会奖项,对挑战性研究的科学研究(探索性)[JSPS Kakenhi Grant Number 19K21593]的授予辅助助理,以及19-7个来自Geriqtrics和Gerontology中心的寿命科学的研究资金, 日本。
-
CRISPR-LICHT:用于人体有机体的突破性新的遗传筛查工具
2022-05-16 -
飞行视觉的秘诀在于快速飞行控制和惊人的快速反应速度
2022-05-10 -
地球上最艰难的生物:耐辐射性的演变比以前的思考更加复杂
2022-05-08 -
与女性朋友在一起的雄性狒狒的寿命更长:强大的对立性债券与更好的生存机会相关
2022-05-07 -
新西兰的南阿尔卑斯山冰川融化量增加了一倍-高达小冰河时期冰川体积的77%已经消失
2022-05-01 -
“合成致死性” - 利用癌症特异性遗传缺陷靶向癌症
2022-05-01 -
阿尔茨海默氏症简单血液测试的进展
2022-05-01 -
人类和苍蝇之间惊人的相似之处:解决大脑如何进化的拼图游戏
2022-04-29 -
番茄的隐藏DNA突变在100个品种的遗传研究中揭示
2022-04-26 -
从jekyll到海德:使大肠杆菌致命的遗传突变精确定位
2022-04-24 -
科学家发现与自闭症谱系障碍有关的新基因突变
2022-04-23 -
现有的用于治疗阿尔茨海默氏病的药物可以逆转糖尿病中的血管损伤
2022-04-22 -
流感突变研究:通用流感疫苗可能比预期的更具挑战性
2022-04-20 -
快速传播的突变有助于常见的流感亚型逃避免疫反应和疫苗
2022-04-20 -
DNA显示植物是非凡的化学家–做爱与战争
2022-04-20