用数学解决的睡眠之谜:细胞质交通拥堵扰乱睡眠-觉醒周期
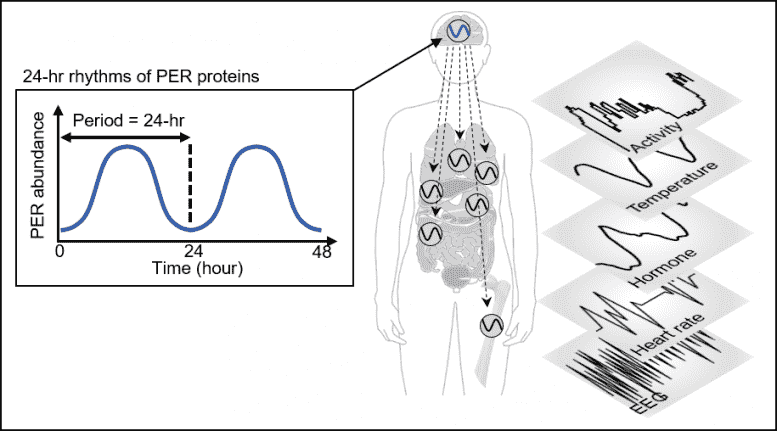
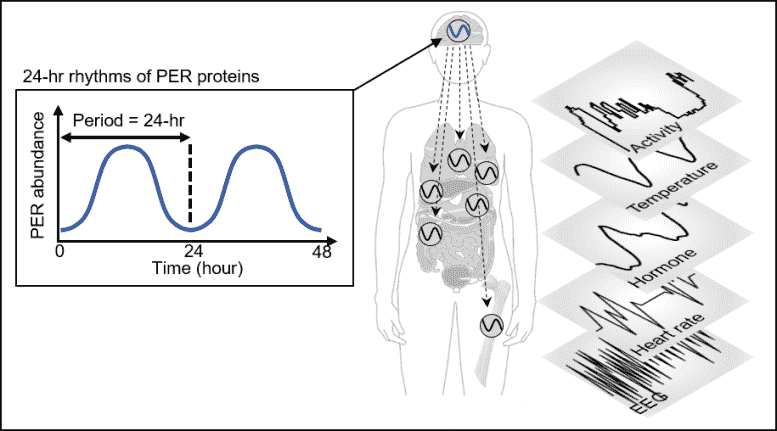
图1。PER丰度通过自动调节的负反馈回路以昼夜节律的方式振荡。这种振荡可以使包括睡眠在内的昼夜节律的生理和行为过程得到强有力的计时。
佛罗里达州立大学的KAIST数学家及其合作者已经确定了衰老和痴呆和肥胖等疾病如何导致睡眠障碍的原理。数学建模和实验的结合表明,由衰老,痴呆和/或肥胖引起的细胞质充血破坏了人体的昼夜节律并导致不规则的睡眠-觉醒周期。这一发现为解决不稳定的睡眠-觉醒周期提出了新的治疗策略。
人体会根据“昼夜节律”调整睡眠时间表,“昼夜节律”由我们的计时系统“昼夜节律时钟”调节。该时钟通过产生一种称为PERIOD(PER)的蛋白质的24小时节律来告诉我们的身体何时休息(见图1)。
PER蛋白的量在一天的一半时间内增加,然后在剩余的一半时间内减少。原理是在细胞质中累积数小时的PER蛋白立即进入细胞核,从而阻碍了PER基因的转录,从而减少了PER的数量。
然而,在复杂的细胞环境中成千上万的PER分子如何同时进入细胞核仍然是个谜,在复杂的细胞环境中,多种物质共存并会干扰PER的运动。这就像为纽约市成千上万的员工每天在同一时间进入办公楼提供一种途径。
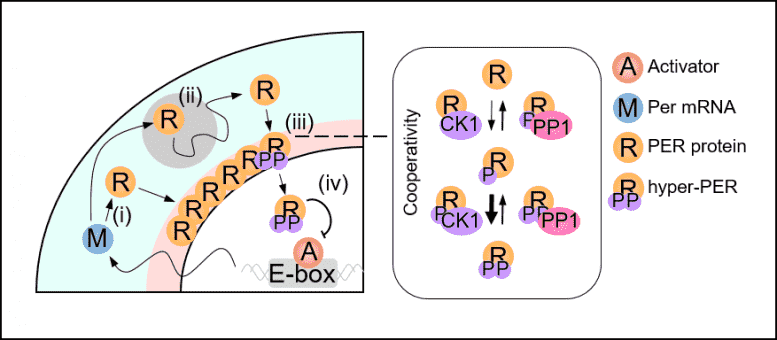
图2。昼夜节律时钟的空间随机模型。在细胞质中将Per mRNA(M)翻译为蛋白质(R)后,PER朝着细胞核过渡,越过障碍而被磷酸化(ii;灰色圆圈)。核周中累积的PER以协同方式被过度磷酸化(iii)。然后它进入细胞核并抑制激活剂A(iv)的转录活性。
由KAIST数学科学系的Jae Kyoung Kim教授领导的一组研究人员通过开发描述细胞环境中PER分子运动的时空和概率模型,解决了这个难题。
这项研究是与佛罗里达州立大学的Choogon Lees教授小组合作进行的,在该小组进行了实验,结果于上个月发表在美国国家科学院院刊(PNAS)上。
联合研究小组的空间随机模型(请参见图2)描述了PER分子在细胞中的运动,并证明了PER分子应在细胞核周围充分凝结,以便同时被磷酸化并一起进入核(请参见图3左)。得益于这种磷酸化同步开关,每天数千个PER分子可以同时进入细胞核并保持稳定的昼夜节律。
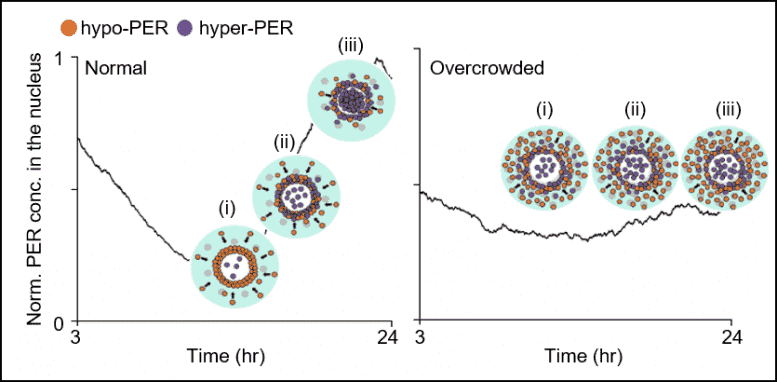
图3。在正常细胞(左)中,与周围细胞质(图2中的青色区域)相比,数小时内的细胞质通量增加了周核中的PER丰度(图2中的粉红色区域)(i)。由于协同作用(ii),这会在周核中引起急剧的开关样超磷酸化,然后在狭窄的时间窗口内(iii)同步进入核。当细胞过度拥挤时(右图),细胞质通量受到阻碍,因此PER不会以与正常细胞(i)相同的梯度积累。这使尖锐的开关状PER过度磷酸化和核进入(ii和iii)失效。
但是,当衰老和/或疾病(包括痴呆和肥胖)导致细胞质充斥着增加的细胞质障碍(例如蛋白质聚集和脂肪空泡)时,就会阻碍PER分子在细胞核周围的及时凝结(请参见右图3)。结果表明,磷酸化同步开关不起作用,PER蛋白会在不规则的时间进入细胞核,从而使昼夜节律和睡眠觉醒周期变得不稳定。
金教授说:“作为一名数学家,我很高兴能够推动新的治疗策略的发展,这种策略可以改善这么多患有不规则睡眠觉醒周期的患者的生活。以这些发现为契机,我希望看到数学和生物科学之间更积极的思想交流和合作。”
参考:Stephen Beesley,Dae Wook Kim,Matthew DAlessandro,Yuanhu Jin,Kwangjun Lee,Hyunjeong Joo,Yang Young,Robert J.Tomko Jr,John Faulkner,Joshua Gamsby,Jae Kyoung Kim严重破坏了觉醒周期和Choogon Lee,2020年10月26日,美国国家科学院院刊。DOI:
10.1073 / pnas.2003524117
这项工作得到了美国国立卫生研究院和美国国家科学基金会,国际人类前沿科学计划组织和韩国国家研究基金会的支持。
-
细胞核的结构如何改变植物中的基因活性
2022-05-21 -
在古老的巨大病毒中,说谎说:Medusavirus键解密进化的谜团
2022-05-08 -
新的研究指出了维持细胞健康的两种运动
2022-03-18 -
科学家展示生长素如何到达目的地
2022-01-30 -
生物学家揭示有丝分裂后细胞如何重建
2022-01-21 -
新研究有助于解释轮班工人患糖尿病的风险增加
2021-10-10 -
神经科学家提高小鼠的触觉敏感性
2021-10-03