化学家揭示了合成胶原纤维如何自组装
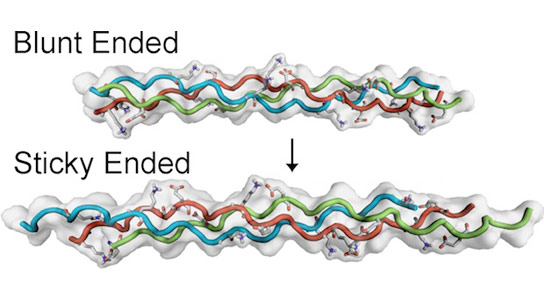
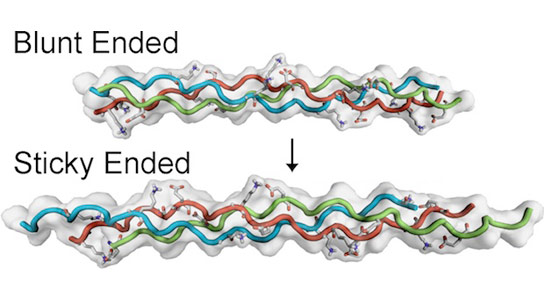
来自稻米大学的两篇新的研究员论文详细介绍了合成胶原纤维如何通过粘性结束自组装。
胶原蛋白是哺乳动物中最常见的蛋白质,骨的主要成分和纤维组织,支持细胞并将器官保持在一起。发现其秘密可能会导致组织工程和化妆品和重建医学更好的合成胶原蛋白。
Jeffrey Hartgerink的稻米实验室一直在研究合成胶原蛋白十年,戏弄了它如何开始的细节,这是三个扭曲成特色三螺旋的三种不同的肽。他的小组已经开发出胶原蛋白用作凝血剂或在再生医学中的脚手架。
“美国化学学会”杂志“中的两篇论文在5月份发表于本月和第二个月,恰恰在水稻中开发的模拟肽可以对准,以与粘性末端形成螺旋,使其允许它们聚集成纤维或凝胶。
“我们在自然化学论文中提出(2011年),肽以抵消方式自组装,以创造粘性的结束,”Hartgerink说。“然后那些粘性的末端可以传播。但即使在审查本文中,该机制也占据了一定数量的Flak,因为在文献中没有报道,胶原蛋白系统实际上可以创造这一抵消。“
他说,它已经采取了几年,这两篇论文证明了批评者错了。
胶原蛋白从三种蛋白质链的螺旋布置中形成,也称为肽。与所有蛋白质一样,链条包括氨基酸如甘氨酸和脯氨酸(胶原的两个主要成分)以一定顺序排列。通过小心地安排氨基酸及其正负电荷,如Hartgerink设计定制纳米链等科学家。
在正确的顺序中,带电的氨基酸交联到Hartgerink呼叫轴向盐桥的非共价键,其在稳定氢键的帮助下保持螺旋。“我们在胶原蛋白完成的大部分工作都是定义那些轴向带电的对,然后利用它们进行不同的东西,”他说。
Hartgerink表示,这些螺旋的末端可以是钝的或粘性的,取决于链条的交错方式或偏移。一个氨基酸的偏移是钝的,根本不粘。偏移量越大,它变成了贴痕。
Hartgerink的第一个新论文,Abihishek Jalan和Katherine Jochim的研究生展示了独立,粘性结束的三螺旋的自我组装,具有四个氨基酸的偏移。他们允许研究人员通过核磁共振(NMR)获得结构的细节。
“我们选择使用一个非常短的偏移,因为我们一定要大得多,它变得贴满,纤维开始形成,”Hartgerink说。“一旦您有光纤,NMR就不再工作了。但NMR是转到分析工具,在这种情况下,我们能够以偏移发生的分子水平显示。“
对于第二篇论文,与研究生萨卡尔和前研究生莱斯利奥尔利的莱斯利,“我们确实反转并合成了一系列具有大粘性末端的肽,即驱动纤维组件,”Hartgerink表示。
研究人员用相同的化学成分制成了两种合成胶原蛋白,但不同的布置,并迅速地自组装成纤维,呈现出广泛的粘性末端。具有未对准性序列的那些形成无定形聚集体或在溶液中保持分离。
“我们选择通过将我们的工作突破到两项研究中满足批评者。一个人在分子水平上证明这些带电的对强大,可以推动这种偏移,这尚未以前展示,而且由此产生的螺旋可能粘稠,“他说。“那么,在第二项研究中,我们实际上使它们粘在一起并表明当您使用充电的成对时,可以获得纤维。当你不这样做时,你不会得到纤维。“
HARTGERINK表示,了解胶原蛋白组件的细节提出了用于特定功能的合成胶原蛋白的可能性。“许多生物材料使用天然胶原蛋白,用合成胶原蛋白更换它们,”他说。“其中一个主要优点是,我们远离与使用动物来源相关的健康和监管问题。”
他说合成胶原蛋白也可能有助于回答有关其自然对应物的重要问题。“胶原蛋白是一种令人难以置信的组织行为中的中央球员,但即使是关于胶原蛋白结构的一些基本思想也已经成为了科学家的几十年,”他说。“我们现在正在追求的事情是产生胶原蛋白模拟肽的文库,以测试它们针对已知的胶原蛋白结合蛋白和蛋白酶,切割胶原蛋白的蛋白质。
“我认为理解机制的困难是通过两个整篇文章来概述它的事实说明了,”Hartgerink说。“但是这些机制研究将使我们能够推动科学向前推进并做更实用的事情。”
国家科学基金会和罗伯特A. Welch基金会支持这项研究。
刊物:
Abhishek A. Jalan等人,“非典型”粘性结束的“胶原三重螺旋”的理性设计,J.IM。化学。SOC。,2014,136(21),PP 7535-7538; DOI:10.1021 / Ja5001246Bizebabla,等,“由三螺旋核心控制的纤维形成胶原模拟肽的自组装”,J.IM。化学。SOC。,2014,136(41),PP 14417-14424; DOI:10.1021 / Ja504377s.图像:礼貌Hartgerink研究组
-
新释放的螺旋星系NGC 201的哈勃图象
2021-09-30 -
螺旋Galaxy Messier 33的新ESO图像
2021-09-29 -
哈勃视图螺旋Galaxy NGC 5793
2021-09-29 -
Star Cluster NGC 3590的新ESO图像
2021-09-24 -
新发布的螺旋星系M33的Herschel图像
2021-09-23 -
近地球小行星1950 da通过凝聚力举起
2021-09-23 -
新模型揭示了壁虎如何坚持对象
2021-09-22 -
哈勃放大螺旋星系IC 2560
2021-09-19 -
哈勃视图螺旋Galaxy NGC 4921
2021-09-18 -
螺旋Galaxy Messier 83的新的Hubble图像
2021-09-13 -
哈勃视图螺旋星系M65
2021-09-13 -
螺旋Galaxy Messier 83的新的Hubble图像
2021-09-13 -
物理学家创造了扭曲光的相干梁
2021-09-12 -
巨大的恒星地图银河系的结构
2021-09-12 -
研究表明螺旋星系比以前的想法大
2021-09-10