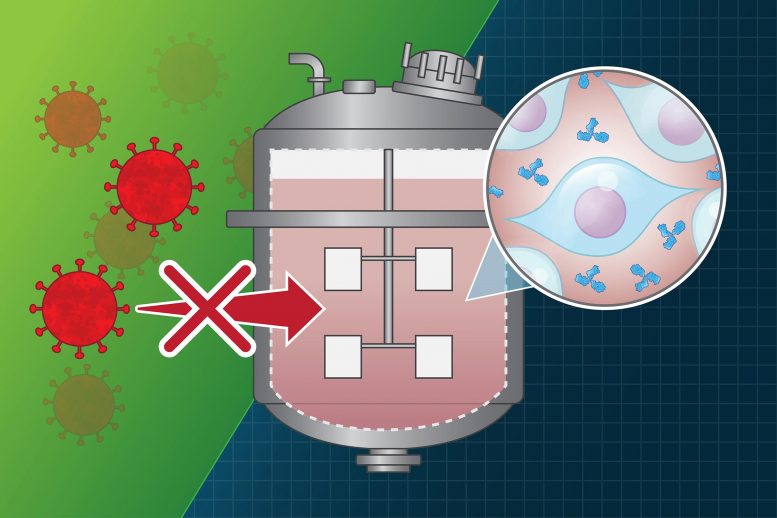
麻省理工学院研究:药品生产厂的药物病毒污染
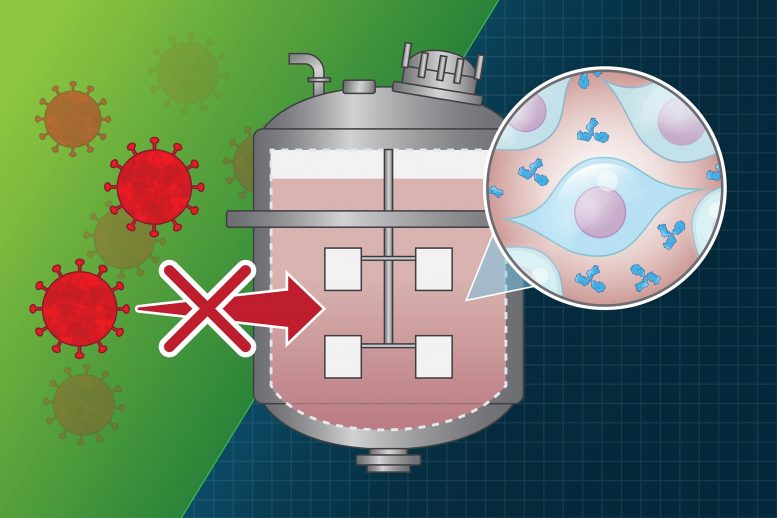
麻省理工学院领导的一个财团的一项新研究分析了18个生物制药工厂的病毒污染事件,提供了对最常见病毒污染源的见解,并提出了一些建议,以帮助公司将来避免此类事件。
在过去的几十年中,发生了几起事件,在制造工厂中,制造蛋白药物的制造过程受到病毒的污染。这些都是在药物到达患者之前就发现的,但是许多事件导致了昂贵的清理工作,在某些情况下甚至导致了药物短缺。
麻省理工学院领导的一个财团的一项新研究分析了其中的18起事件,其中大多数至今尚未公开报道。该报告深入了解了最常见的病毒污染源,并提出了一些建议,以帮助公司将来避免此类事件的发生。
虽然研究的重点是生物药物(活细胞产生的蛋白质药物),但研究结果还可以帮助生物技术公司为新基因疗法和基于细胞的疗法的生产制定安全指南,其中许多正在研发中并且可能面临类似的挑战。污染风险。
“随着生物技术行业开始考虑生产这些非常令人兴奋的新产品,这些产品非常有效,甚至在某些情况下可以治愈,我们希望确保考虑到制造它们的病毒安全性,”高级总监Stacy Springs说麻省理工学院生物医学创新中心(CBI)的课程。
斯普林斯是该研究的资深作者,该研究于2020年4月27日发表在《自然生物技术》上。主要作者是生物制造中不定因素污染联盟(CAACB)的负责人Paul Barone。来自CBI的其他作者是Jackie Wolfrum(与Barone共同担任CBI的生物制造计划),以及Michael Wiebe和James Leung(与CAACB的行业专家一起从事这项研究)。
分享信息
许多治疗性蛋白质是使用重组DNA技术生产的,重组DNA技术允许对细菌,酵母或哺乳动物细胞进行工程改造以产生所需的蛋白质。尽管这种做法具有很强的安全性记录,但存在培养的哺乳动物细胞可能被病毒感染的风险。进行这项研究的CAACB于2010年在波士顿Genzyme制造工厂发生了一起广为人知的污染事件后启动。2009年,该厂的某些生产过程被病毒感染后,该厂不得不关闭了大约10个月。
发生此类事件时,除非该事件影响其提供药物的能力,否则制药公司无需将其公开。CBI团队组建了一个由20家公司组成的公司,它们愿意共享有关此类事件的信息,但前提是该数据将以匿名方式发布。
斯普林斯说:“我们认为,与业界分享他们在病毒污染方面的经验非常有价值,因为如果幸运的话,大多数公司都不会发生这些事件,或者最多不会发生一两次。”“关于他们如何发现和管理事件,识别病毒及其来源,消毒并重新启动生产设施以及采取行动以防止再次发生的所有这些知识,在整个公司中都是孤立无援的。”
这项针对哺乳动物细胞产生的蛋白质药物的研究揭示了自1985年以来发生的18次病毒污染事件。这些发生在报告数据的20家生物制药公司中的9家。在12起事件中,被感染的细胞是中国仓鼠卵巢(CHO)细胞,通常用于生产蛋白质药物。其他事件涉及人类或非人类的灵长类细胞。
在人类和非人类的灵长类动物细胞中发现的病毒包括疱疹病毒。人腺病毒,引起普通感冒;和呼肠孤病毒,可引起轻度胃肠炎。研究人员认为,这些病毒可能是从工厂的工人那里传播的。
在许多情况下,由于细胞正在死亡或看起来不健康,首先会检测到污染事件。在两种情况下,细胞看上去正常,但是通过所需的安全性测试检测到病毒污染。最常用的测试至少需要两周的时间才能得出结果,因此在被检测到之前,污染性病毒可以在整个生产过程中进一步传播。
一些公司还使用基于聚合酶链反应(PCR)技术的更快的测试,但是该测试必须进行定制以查找特定的DNA序列,因此,当制造商知道最有可能在其中发现的特定病毒时,此方法最有效。他们的制造过程。
FDA药物评估与研究中心主任珍妮特·伍德考克(Janet Woodcock)说:“这项工作证明了如何共享数据和信息可以更好地理解生物制剂生产中的难题。”“正在研究新流程或产品的创新者可以通过学习此处记录的过去的集体经验来避免陷阱或灾难。”
新技术
许多CAACB成员公司正在探索新技术,以在使用前灭活或去除细胞培养基中的病毒,以及在纯化过程中灭除病毒。另外,公司正在开发快速的病毒检测系统,该系统既敏感又能够检测各种病毒。
CBI研究人员还在研究几种技术,这些技术可以使病毒污染的检测更加快速。这项研究的大部分内容都在新加坡-麻省理工学院科学与技术联盟(SMART)的一个新的跨学科研究小组内进行,该小组称为制造个性化药物的关键分析。在麻省理工学院副教务长兼生物工程和材料科学与工程学教授Krystyn Van Vliet的带领下,该小组由来自各个部门的其他MIT教职人员组成,他们正在研究大约六种技术,以更快速地检测病毒和其他病毒。微生物。
“我认为技术开发有很大的潜力来缓解我们看到的一些挑战,” Barone说。
该报告建议并且一些公司已经在使用的另一种策略是减少或取消使用源自动物产品(例如牛血清)的细胞生长培养基成分。如果无法做到这一点,另一种策略是在使用介质之前对介质进行病毒清除或灭活处理,这可以防止病毒进入并污染制造过程。一些公司正在使用类似于巴氏灭菌法的过程,称为高温短时(HTST)处理,而其他公司则使用紫外线或纳滤。
研究人员希望他们的研究也将有助于指导新的基因和细胞疗法产品的制造商。研究人员说,这些利用基因或细胞替代缺陷细胞或在体内产生治疗分子的疗法可能面临与生物药物类似的安全挑战,因为它们通常在含有牛血清或人血清的培养基中生长。
“通过系统的方式进行信息共享,我认为我们不仅可以在蛋白质制造行业内,而且可以在基于细胞的新模式行业中加快最佳实践信息的传播,” James Leung说。
参考:Paul W. Barone,Michael E. Wiebe,James C. Leung,Islam TM Husinin,Flora J. Keumurian,James Bouressa,Audrey Brussel,Dayue Chen,Ming Chong,Houman撰写的“生物制品制造中的病毒污染及其对新兴疗法的影响” Dehghani,Lionel Gerentes,James Gilbert,Dan Gold,Robert Kiss,Thomas R.Kreil,RenéLabatut,Yuling Li,JürgenMüllberg,Laurent Mallet,Christian Menzel,Mark Moody,Serge Monpoeho,Marie Murphy,Mark Plavsic,Nathan J.Roth ,David Roush,Michael Ruffing,Richard Schicho,Richard Snyder,Daniel Stark,Chun Zhang,Jacqueline Wolfrum,Anthony J.Sinskey和Stacy L.Springs,2020年4月27日,在Nature Biotechnology.DOI:
10.1038 / s41587-020-0507-2
这项研究是由民航总局的成员资助的。
-
鼠标耳声音传感器的发育地图,用于听力损失的干细胞疗法
2022-04-18 -
基于干细胞的新型局部解决方案可帮助秃头人恢复头发生长
2022-04-17 -
在南澳大利亚的飞行狐狸暴露于动物园病毒
2022-04-14 -
太赫兹辐射可以破坏活细胞中的蛋白质 - 与常规信念相反
2022-04-14 -
水中的东西:环境污染物可能比以前想象的更危险
2022-04-14 -
铁纳米罗巴氏虫去卧底以跟踪身体内的活细胞
2022-04-13 -
科学家创造出模仿天然细胞的合成红细胞,并具有新的能力
2022-04-13 -
“细胞毛孔”发现为百万脑和脊髓损伤提供了新的希望
2022-04-12 -
纳米器件从内部追踪细胞,展示它们如何随着时间发展
2022-04-12 -
创新性病毒研究可拯救小麦和其他农作物
2022-04-12 -
使用新型纳米颗粒开发的通用流感疫苗
2022-04-11 -
识别出免疫活性的“刹车”后新的抗癌治疗前景
2022-04-11 -
我们骨头中新发现的记忆:记录以前的感染情况以增强免疫力
2022-04-11 -
斯坦福科学家基因上重新编程细胞以构建人工结构
2022-04-10 -
研究人员发现压力如何重组大脑
2022-04-10