糖分子有助于抗击致病性螺旋菌菌株
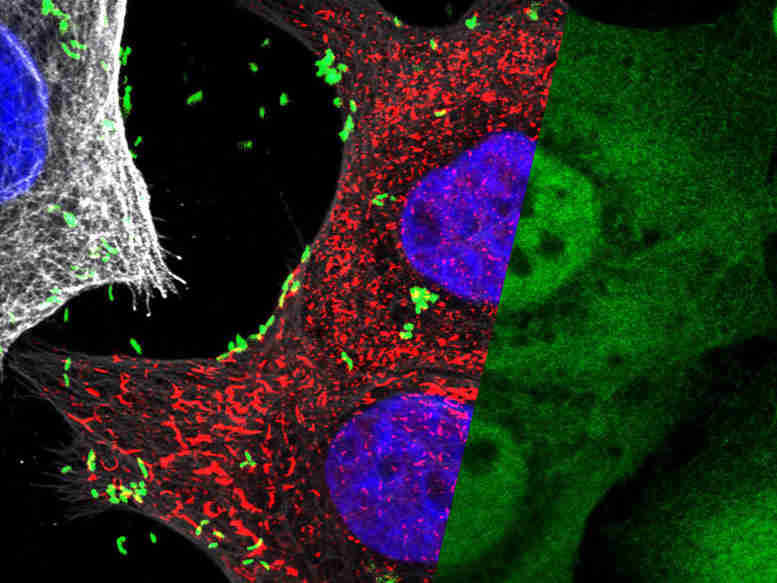
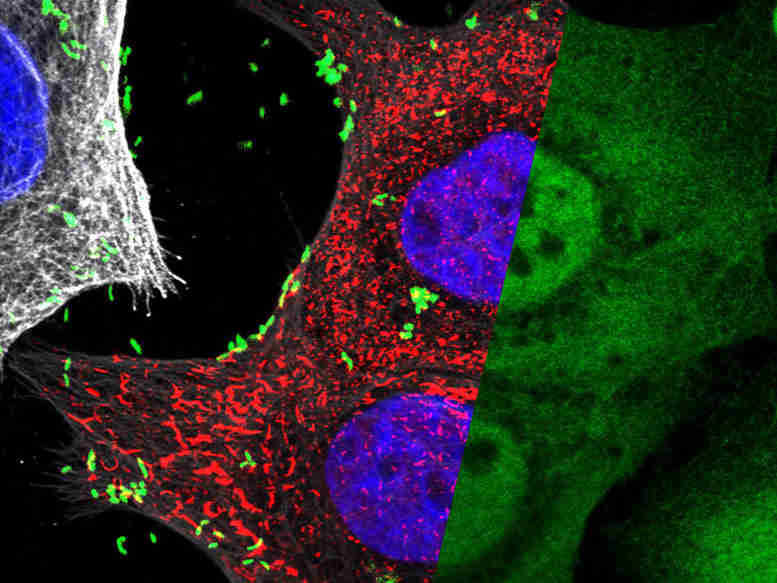
用幽门螺杆菌(绿色细菌)感染的椎间盘状核(蓝色)的人胃上皮细胞。在将小糖分子(HBP)注射到宿主细胞中以使宿主细胞中的小糖分子(HBP)形成,以使促炎NF-KB转录因子(扩散绿色)转移到核中,如右侧所示 - 答题显微照片通道。白色/灰色染色代表人体细胞的微管网络(左图)。mpi f。感染生物学/ L. Pfannkuch
Max Planck Institute的研究人员发现了一种新的先天监测机制,用于抵抗致病性幽灵菌株。
所有人中的一半是慢性感染幽门螺杆菌,是一种革兰阴性细菌,在胃癌的发展中起着致病作用。它有两种类型,一种相对无害的,另一种是六倍的癌症风险。危险菌株通过激活核因子κB(NF-B)导致胃粘膜中特别强烈的炎症,该基于组织κ的先天免疫应答的“母部开关”,这迅速触发引发局部炎症的基因的转录。然而,H. Pylori触发NF-B的统κ计统计学是多么神秘。现在,柏林最大普朗克感染生物学研究所的团队表明,细菌用糖分子注射宿主细胞,称为HBP,仅在革兰氏阴性细菌中发现,通过κ新的途径激活NF-B。研究人员发现,注射HBP的结果是非常大的复合物的快速组装,所谓的Tifasomes,其含有许多蛋白质有助于在感染的胃组织中促进抗微生物炎症反应。
富含胃肠道的慢性炎症是促进癌症的发育,从而了解发起和控制组织水平炎症的机制对人类健康感兴趣。H.幽门螺杆菌导致终身感染,维持不断增加的炎症反应。这样,病原体会导致胃炎和胃溃疡,并且是第一个被认为是致癌的细菌。有趣的是,IV型分泌系统(T4SS)的存在或不存在有两个主要菌株 - 细菌使用的机器将分子直接喷射到宿主细胞中,使它们颠覆它们的功能。港口T4SS的菌株会导致更严重的炎症,并且更有可能导致溃疡和癌症 - 至关重要,它们也是强烈激活母炎稳压剂NF-B的肿瘤和癌症。κ
胃衬里的细胞如何能够区分这些高毒性从较少的毒性H. Pylori几十年来的剧烈研究的主题。到目前为止,注入的毒力蛋白Caga,其触发了宿主细胞的多种有害变化,是已知由H. Pylori的T4S旋转的唯一分子。科学家自然地看着这个分子来找到答案,但无法识别允许免疫系统检测到的明确机制。
由Thomas F. Meyer领导的基于柏林的Max Planck感染生物学研究所的团队决定使用RNAi干扰技术进行无偏见的基因组方法,并检查哪些人类基因参与激κ活NF-B。 “特别是,与胃组织的其他炎症刺激相比,我们对感染后激活的基因感兴趣。我们怀疑所涉及的途径是不同的。“实际上,筛选鉴定了一个名为ALPK1和TIFA的两种独特的分子,其仅κ响应于H. Pylori感染而被激活NF-B。随后的研究表明,ALPK1激酶导致TIFA的磷酸化,然后触发大蛋白质复合物的快速组装,称为TIFasomes。这些配合物构成了与经典NF-B途径的联κ系。“当我们使用荧光标记的TIFA细胞的时间流逝显微镜检查时,我们对这些TIFA复合物形成了多么迅速,并且它们有多大,”梅耶尔说。“然后我们实现了这些Tifasomes含有多少种不同的蛋白质。显然,他们在开始对感染的其他反应中发挥作用,我们尚未理解。“
然而,问题仍然是H. Pylori在这一事件中举行的幽门螺杆菌。当另一个组发现HBP,革兰阴性细菌脂多糖合成的糖分子前体能够刺激Tifasome的形成,如果这种糖分子可以是H.Pylori NF-B活化的触发,则该团队测κ试。实际上,他们观察到H.幽门螺杆菌的HBP可以激活TIFA,但对于该H.幽门螺旋螺旋螺旋螺旋螺旋螺旋螺旋螺旋杆菌可能需要运作的T4SS。通过毒力相关的T4S发生HBP的实现,令人惊讶的是,假设仅仅传递传奇。由于T4S被认为是H. Pylori毒力的主要决定因素,因此它特别释放HBP的事实说明了我们的身体如何在高致病性和较少的致病菌株之间辨别。只有高度致病的菌株挑起强烈的炎症,而我们的胃粘膜仍然持肺部不具有T4S的较低的致病菌菌株。
出版物:Stephanie Zimmermann,等人,“Alpk1和Tifa依赖先天免疫反应,由幽门螺杆菌型IV分泌系统引发,”细胞报告,2017年; DOI:10.1016 / J.CELREP.2017.08.039
-
糖分子有助于抗击致病性螺旋菌菌株
2022-01-14 -
新的耶鲁学习在炎症和老化中定位关键途径
2021-12-20 -
减少炎症而不影响脂质水平减少心血管疾病
2021-12-19 -
耶鲁大学新研究探索心血管疾病科学
2021-12-10 -
新的微流体筛查装置可以加速细菌中的DNA插入
2021-11-24 -
研究人员更接近开发更好的疫苗
2021-10-17 -
耶鲁大学的研究揭示了节食和禁食的抗炎机制
2021-10-14 -
Th17细胞从促炎致炎症转化为抗炎
2021-10-12 -
科学家们揭示了“微生物暗物质”可能引起疾病的新光线
2021-10-11 -
纳米管结构能够直接交换细菌之间的营养素
2021-10-11 -
炎症与癌症之间的联系
2021-10-11 -
印度H1N1的新菌株引起了关注
2021-10-09 -
新发现的蛋白质为癌症治疗提供了巨大的潜力
2021-09-04 -
巴斯夫投资生物技术初创公司Bota Bio
2021-09-01 -
新的酵母菌株可以提高乙醇生产效率
2021-07-13